
Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Nový přístup blokuje adaptaci rakovinných buněk a zdvojnásobuje účinnost chemoterapie
Naposledy posuzováno: 27.07.2025
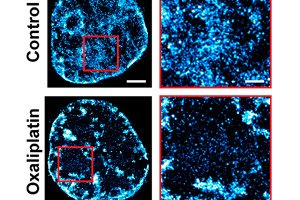
V rámci zcela nového přístupu k léčbě rakoviny biomedicínští inženýři z Northwestern University zdvojnásobili účinnost chemoterapie v experimentu na zvířatech.
Namísto přímého útoku na rakovinu tato unikátní strategie zabraňuje vývoji rakovinných buněk a jejich vzniku v rezistenci vůči léčbě, čímž se onemocnění stává náchylnějším k existujícím lékům. Tento přístup nejenže prakticky vymýtil onemocnění v buněčných kulturách, ale také významně zlepšil účinnost chemoterapie u myších modelů rakoviny vaječníků.
Studie byla publikována v časopise Proceedings of the National Academy of Sciences.
„Rakovinné buňky se skvěle adaptují,“ říká Vadim Backman z Northwestern University, který studii vedl. „Dokážou se přizpůsobit téměř čemukoli. Nejprve se naučí, jak se vyhnout imunitnímu systému. Pak se naučí, jak odolávat chemoterapii, imunoterapii a ozařování. Když se stanou rezistentními vůči těmto léčebným postupům, žijí déle a získávají nové mutace. Nechtěli jsme rakovinné buňky přímo zabíjet. Chtěli jsme jim vzít jejich superschopnost – jejich vrozenou schopnost adaptovat se, měnit se a vyhýbat se.“
Backman je profesorem biomedicínského inženýrství a medicíny na McCormick School of Engineering při Northwestern University, kde vede Centrum pro fyzikální genomiku a inženýrství. Je také členem Komplexního onkologického centra Roberta H. Leuryho, Ústavu pro chemii životních procesů a Mezinárodního institutu pro nanovědy.
Chromatin je klíčem k přežití rakoviny
Rakovina má mnoho charakteristických rysů, ale jeden je základem všech: její neúnavná schopnost přežít. I když imunitní systém a agresivní lékařská léčba napadnou nádor, rakovina se může zmenšit nebo zpomalit růst, ale jen zřídka úplně zmizí. Ačkoli genetické mutace přispívají k rezistenci, probíhají příliš pomalu, než aby vysvětlovaly rychlou reakci rakovinných buněk na stres.
V sérii studií Backmanův tým odhalil základní mechanismus, který tuto schopnost vysvětluje. Schopnost rakoviny adaptovat se a přežít i ty nejsilnější léky určuje komplexní organizace genetického materiálu zvaného chromatin.
Chromatin, skupina makromolekul zahrnující DNA, RNA a proteiny, určuje, které geny jsou potlačeny a které jsou exprimovány. Aby se dva metry DNA tvořící genom vešly do prostoru o velikosti pouhé setiny milimetru uvnitř buněčného jádra, je chromatin extrémně zhutněný.
Kombinací zobrazování, modelování, systémové analýzy a experimentů in vivo Backmanův tým zjistil, že 3D architektura tohoto balíčku nejen řídí, které geny jsou aktivovány a jak buňky reagují na stres, ale také umožňuje buňkám fyzicky zakódovat „paměť“ transkripčních vzorců genů do geometrie samotného balíčku.
Trojrozměrné uspořádání genomu funguje jako samoučící se systém, podobný algoritmu strojového učení. Během „učení“ se toto uspořádání neustále reorganizuje do tisíců nanoskopických domén chromatinu. Každá doména uchovává část transkripční paměti buňky, která určuje, jak buňka funguje.
Přeprogramování chromatinu pro vylepšení chemoterapie
V nové studii Backman a jeho kolegové vyvinuli výpočetní model, který využívá fyzikální principy k analýze toho, jak uspořádání chromatinu ovlivňuje pravděpodobnost přežití rakovinných buněk po chemoterapii. Aplikací modelu na různé typy rakovinných buněk a třídy chemoterapeutických léků tým zjistil, že dokáže přesně předpovědět přežití buněk – a to ještě před zahájením léčby.
Protože je balení chromatinu zásadní pro přežití rakovinných buněk, vědci si položili otázku: co by se stalo, kdyby se změnila architektura balení? Místo vytváření nových léků testovali stovky existujících léků, aby našli kandidáty, které by mohly modifikovat fyzické prostředí uvnitř buněčných jader a ovlivnit balení chromatinu.
Tým nakonec zvolil celekoxib, protizánětlivý lék schválený americkým Úřadem pro kontrolu potravin a léčiv (FDA), který se již používá k léčbě artritidy a kardiovaskulárních onemocnění a jehož vedlejším účinkem je změna uspořádání chromatinu.
Experimentální výsledky
Kombinací celekoxibu se standardní chemoterapií vědci zaznamenali významný nárůst počtu odumřelých rakovinných buněk.
V myších modelech rakoviny vaječníků snížila kombinace paklitaxelu (běžného chemoterapeutického léku) a celekoxibu rychlost adaptace rakovinných buněk a zlepšila potlačení růstu nádoru, čímž překonala účinek samotného paklitaxelu.
„Když jsme použili nízkou dávku chemoterapie, nádory dále rostly. Jakmile jsme ale k chemoterapii přidali kandidáta na TPR (regulátor transkripční plasticity), zaznamenali jsme mnohem výraznější inhibici růstu. Zdvojnásobila se tak účinnost,“ řekl Backman.
Možné vyhlídky
Tato strategie by mohla lékařům umožnit používat nižší dávky chemoterapie, čímž by se snížily závažné vedlejší účinky. To by výrazně zlepšilo pohodlí pacientů a jejich zkušenosti s léčbou rakoviny.
Backman se domnívá, že přeprogramování chromatinu by mohlo být klíčem k léčbě dalších komplexních onemocnění, včetně kardiovaskulárních a neurodegenerativních onemocnění.
